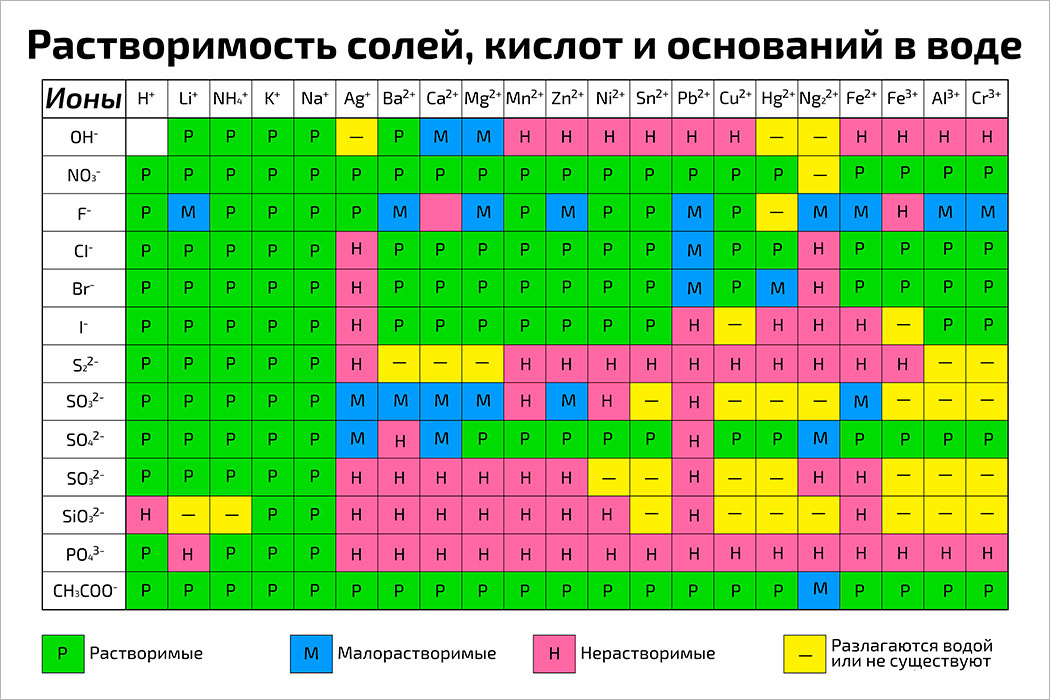
Плакат А1 ламинир. Таблица растворимость солей, кислот и оснований в воде плакат по химии
Полезные формулы для расчёта pH растворов электролитов (сильных и слабых кислот и оснований, солей, амфолитов, буферных растворов). Раствор электролита Перейти к содержанию Search for: Главная Услуги Решение задач по химии онлайн Онлайн помощь по химии Бесплатная помощь с решением задач по химии Помощь с решением олимпиадных задач по химии

Правила и таблица растворимости кислот, солей и оснований в воде
Химические свойства основных солей. Термическое разложение: [Cu (OH)] 2 CO 3 = 2CuO + CO 2 + H 2 O. Реакции солей с кислотами — образование средней соли: Sn (OH)Cl + HCl = SnCl 2 + H 2 O. Диссоциация — так же как и.

Таблица Кислот Фото Telegraph
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al 2 O 3, Fe 2 O 3, Cr 2 O 3, MnO 2, PbO, PbO 2, Ga 2 O 3. С водой они не взаимодействуют.

Электронносправочный стенд таблица "Растворимость кислот, оснований и солей в воде
Соли - это кристаллические вещества разных цветов. Основные физические свойства солей: ионная кристаллическая решётка; высокие температуры плавления; в твёрдом состоянии плохо проводят электричество; по растворимости выделяют растворимые, малорастворимые и нерастворимые соли. Рис. 2. Ионная кристаллическая решётка.

Растворимость кислот, оснований и солей в воде Сервисцентр, Акцепт
Восьмой класс по химии - время для изучения важных групп веществ, в том числе основ, кислот, солей и оксидов. Ниже представлена таблица, которая поможет вам лучше разобраться в свойствах.
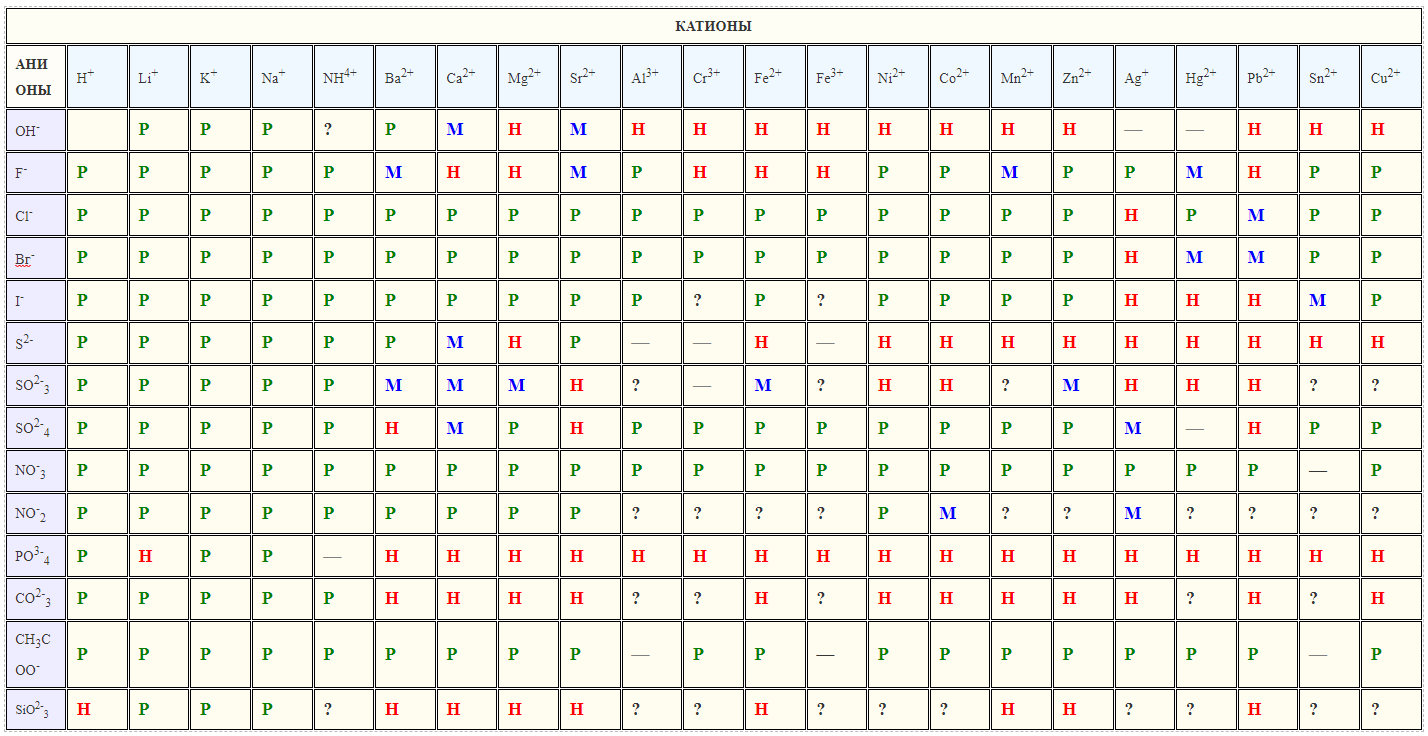
Таблица Растворимость кислот, оснований и солей в воде matematicus.ru
Таблица растворимости солей, кислот и оснований в воде с названиями при различных температурах Химия Таблица растворимости Как пользоваться таблицей растворимости химических веществ Содержание: Растворимость веществ в химии Способы выражения характеристик растворимости Влияние условий на растворимость Как определяется растворимость веществ

Стенд Vivay Таблица растворимости кислот оснований и солей в воде 58x41 см (7531) низкие цены
Полная таблица растворимости солей, кислот и оснований Стандартная (школьная) таблица растворимости Таблица растворимости вместе с таблицей Менделеева являются основным теоретическим материалом при изучении химии!
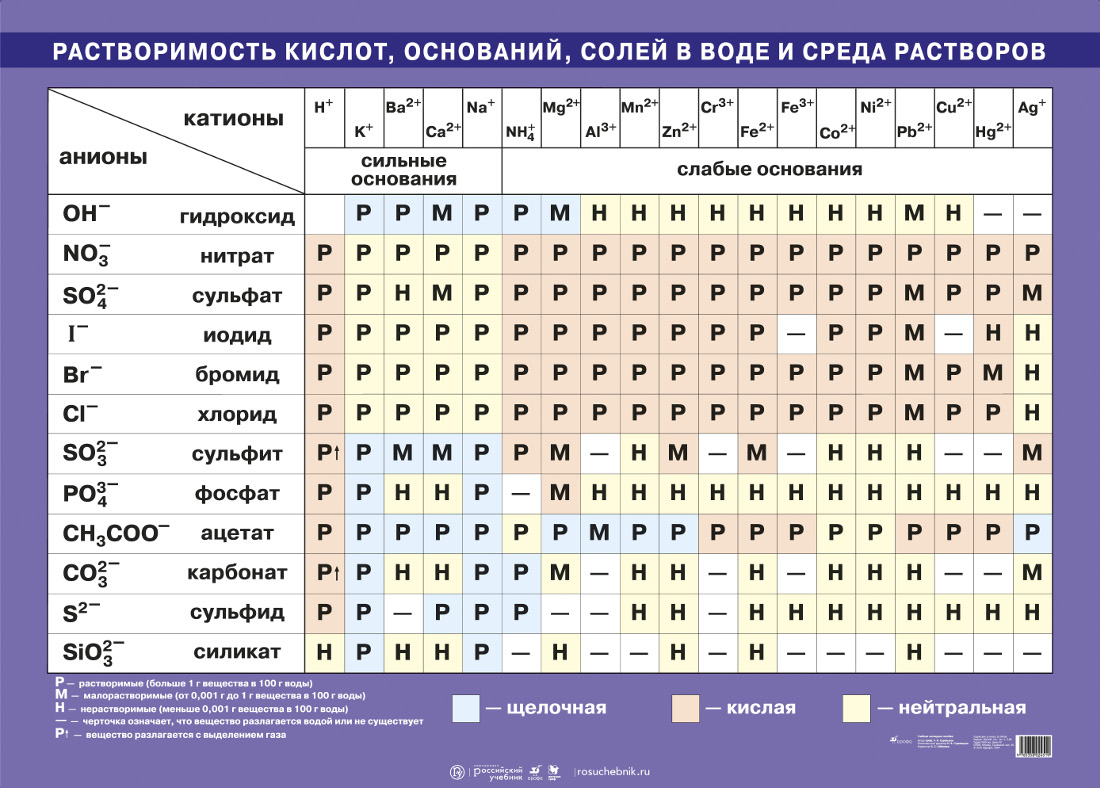
Димедрол Растворимость В Воде Telegraph
В зависимости от конкретных кислот и оснований, могут образовываться различные соли и вода. Таблица сравнения кислот и оснований. такими как реакция с кислотами и образование солей.
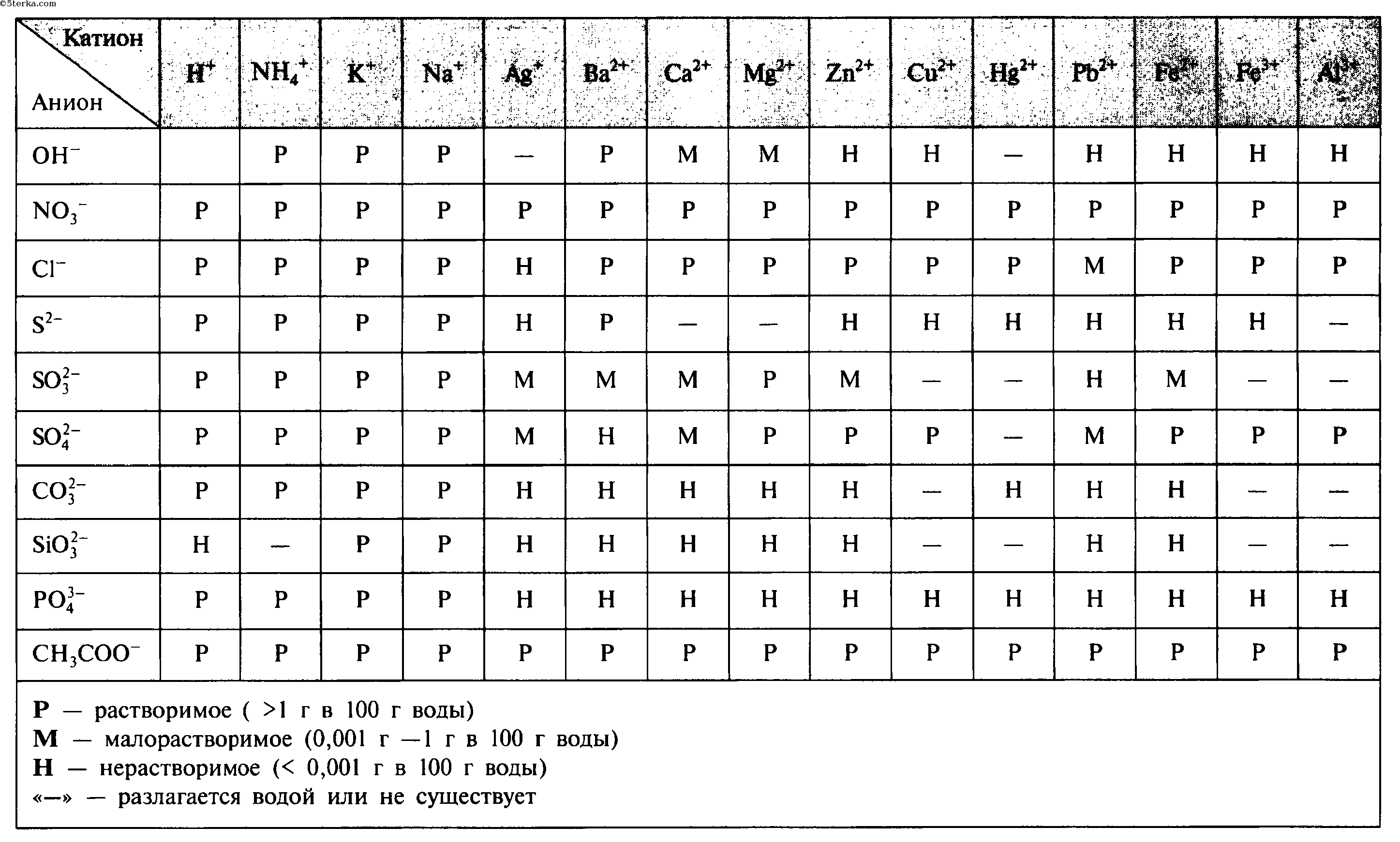
Таблица растворимости солей, кислот и оснований в воде
Таблица растворимости солей, кислот и оснований. Таблица растворимости вместе с таблицей Менделеева являются основным теоретическим материалом при изучении химии! Растворимость.

Егэ Таблица Растворимости Таблица растворимости / Таблицы растворимость кислот, солей и
Самоионизация воды В чистой воде самопроизвольно образуются ионы водорода вследствие диссоциации (ионизации) небольшого процента молекул воды. Этот процесс называется самоионизацией воды: H 2 O ж (ж). () ⇌ H + (aq) + OH − (aq) Буквы в скобках означают, что вода находится в жидком состоянии (ж), а ионы — в водном растворе (aq).
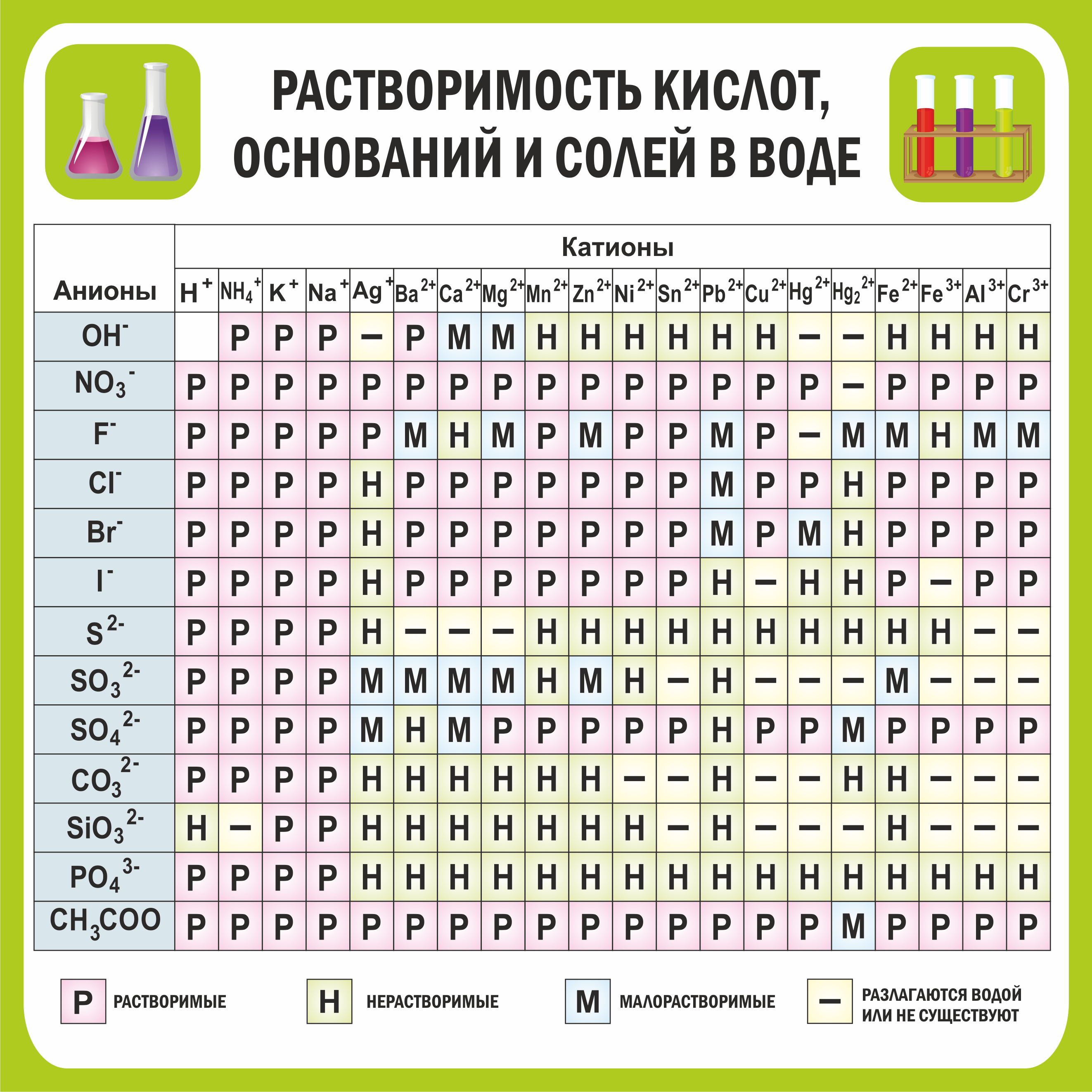
Обучающий стенд по химии ТАБЛИЦА РАСТВОРИМОСТИ СОЛЕЙ 0,7*0,7м арт. 3201 купить в Челябинске по
Таблица классификации солей (пояснения к схеме) Таблица способы получения солей Химические свойства солей (таблица) Вывод: свойства солей определяются ионами металлов и кислотных остатков, которые находятся в их растворах. Похожие таблицы Понятие и классификация солей, их химические свойства и способы получения (в виде таблиц и схем)
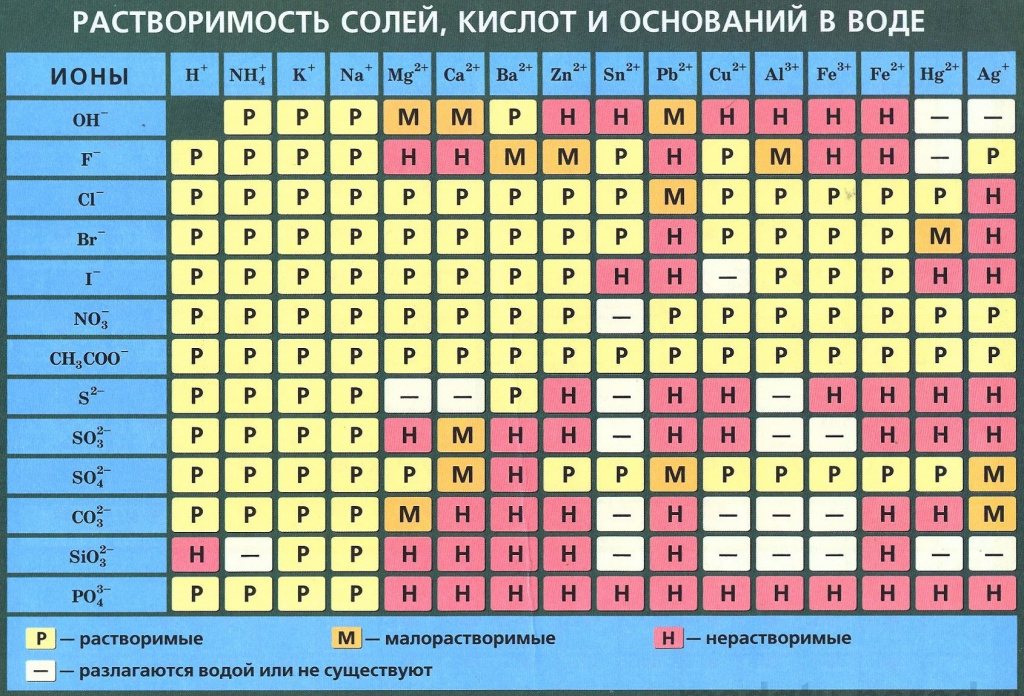
Таблица растворимости веществ по химии ℹ️ список значений растворимости для солей, кислот и
Растворимость солей, кислот и оснований в воде при комнатной температуре (Таблица) Даты основания присоединения штатов США (Список)
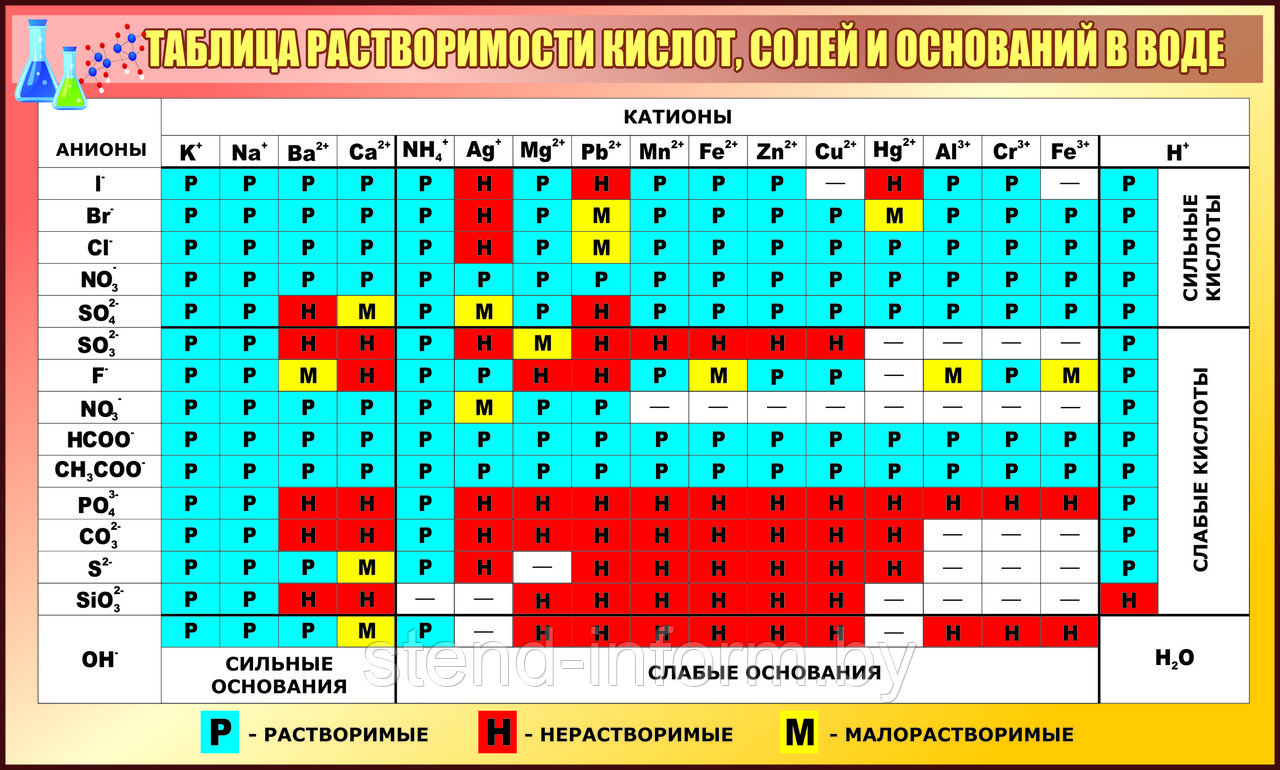
Стенд по химии "Таблица растворимости кислот, солей и оснований в воде" рр 100*61 см, в розовом
Таблица кислот оснований и солей как определить 12 июня, 2021 Кислоти, основания, соли основные свойства HCl — соляная (хлориды) HNO 3 — азотная (нитраты) H 2 S — сероводород (сульфиды) NaOH — гидроксид натрия KOH — гидроксид калия Ca (OH) 2 — гидроксид кальция Ba (OH) 2 — гидроксид бария Mg (OH) 2 — гидроксид магния
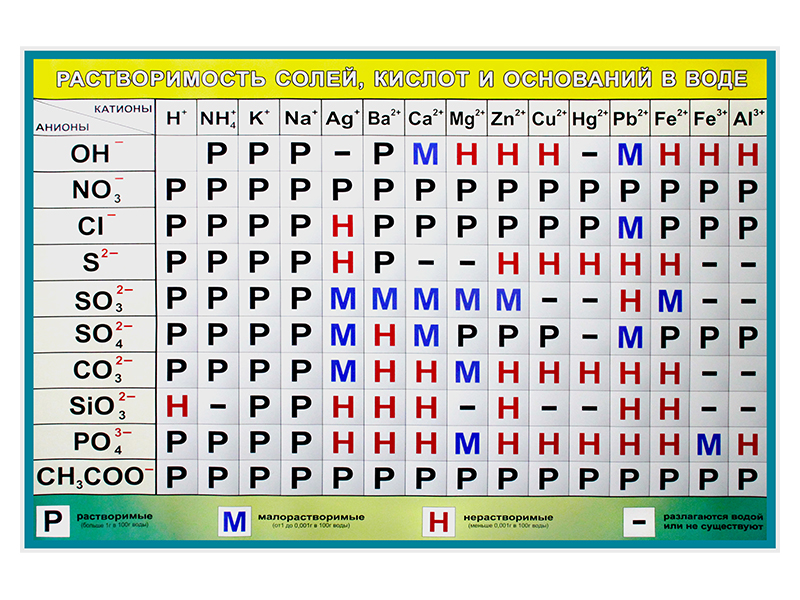
Виниловая таблица "Растворимость солей, кислот и оснований в воде" (раздел «Демонстрационные
Таблица растворимости веществ обычно содержит информацию о растворимости солей, кислот, оснований и других веществ. Растворимость обычно указывается в г/100 мл растворителя или в моль/литр.
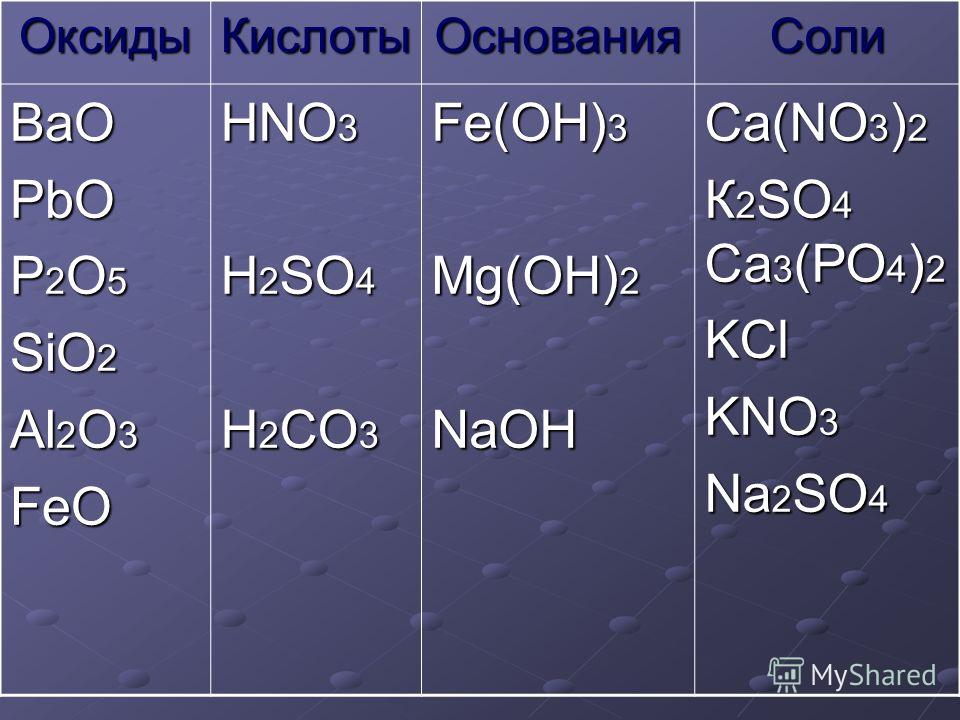
Химия соли и кислоты Общая характеристика солей — урок. Химия, 89 класс. — Детская игровая
Таблица растворимости кислот, солей и оснований в воде. Условные обозначения: «Р» - растворяется (>1 г на 100 г h 2 o); «М» - мало растворяется (от 0,1 г до 1 г на 100 г h 2 o); «Н» - не растворяется (<0,01 г на 1000 г h 2 o);
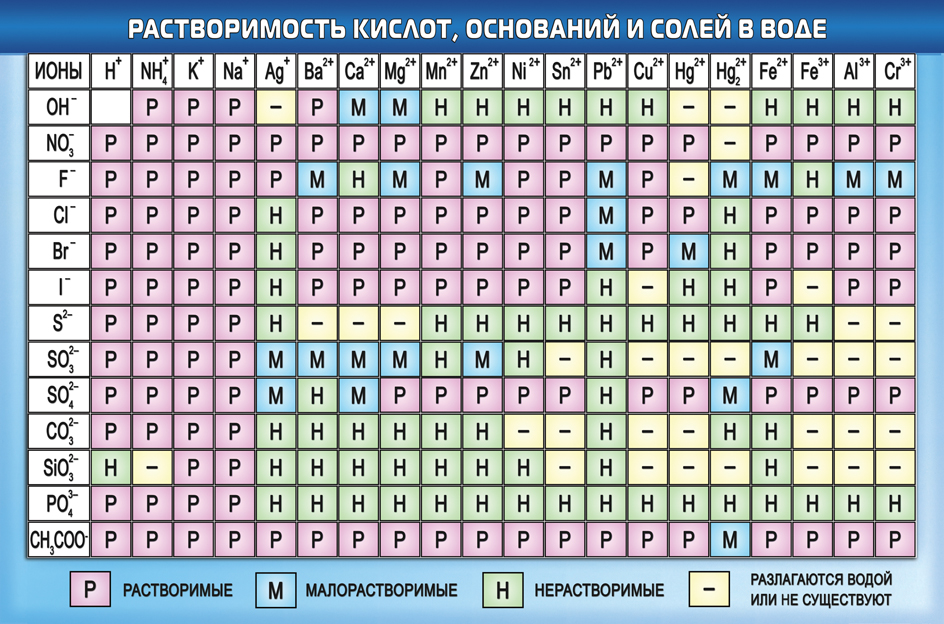
Таблица Растворимость солей, кислот и оснований в воде 70х100 винил, цена 1 743,00 руб
Таблица способы получения солей. Взаимодействия кислот и оснований. koh + hcl → kcl + h 2 o. Взаимодействия кислот с основными оксидами. Взаимодействия щелочей с кислотными оксидами